
研究開発
現在から将来に至る企業環境の変化を予測し、事業ポートフォリオマネジメントを設計・構築しています。事業ポートフォリオを分析し、経営資源の調達と循環、戦略的な資産構築と資産活用、企業価値の持続的向上の視点から、現在、大きく分類して3つの研究開発パイプラインをはしらせています。
■体外医薬品原料開発
体外医薬品のうち、迅速免疫血清検査(ラテックス凝集法)用の原料について共同研究を進めています。
現在、免疫血清検査の主流はELISA法(酵素結合免疫吸着測定法)という抗原抗体反応の原理を利用して目的とする成分を検出する方法です。これに対し、ラテックス凝集法による免疫血清検査は、EISA法に対し検査の感度とダイナミックレンジの点で大きく見劣りする一方、極めて迅速に検査結果を得ることができるという利点があります。
ラテックス凝集法による免疫血清検査において感度が上がらない最大の理由は、原料として用いる医用ナノ粒子の性能不足にあります。
■ラテックス凝集法の検査メカニズム
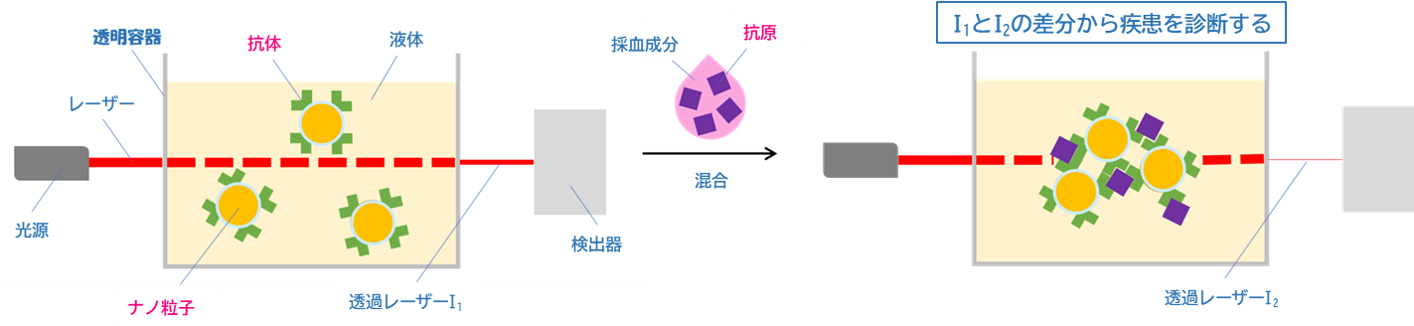
- 先ず、透明容器にラテックス凝集法用試薬(免疫血清検査用体外医薬品)を入れておきます。この試薬は、医用ナノ粒子表面に抗原(病気に由来するタンパク質)を特異的に補足する抗体というタンパク質を固定化し、この抗体固定化医用ナノ粒子を水溶液中に分散することで構成されています。
- 次に、透明容器に対してレーザー光を照射し、照射面の逆側から透過してくるレーザー光の強度を測定します。医用ナノ粒子は非常にサイズが小さく、光散乱などが生じにくいことから、照射したレーザー光の強度と透過してくるレーザー光の強度は同程度となります。
- この透明容器に、血液検体を混合します。
- もし血液検体中に抗原が含まれる場合、抗原抗体反応(抗体が抗原を特異的に補足しようとする挙動)に引きずられる形で抗体固定化医用ナノ粒子同士が凝集して凝集体を形成します。この凝集体はサイズが大きいため、光散乱などを生じ、透過してくるレーザー光の強度を大きく減衰させてしまいます。
- もし血液検体中に抗原が含まれない場合、抗原抗体反応が生じず抗体固定化医用ナノ粒子は分散状態を保ち、血液検体混合前後で透過してくるレーザー光の強度は変化しません。
試薬に血液検体を混合する前後における透過してくるレーザー光の強度変化の程度を計測することによって、病気の有無やその重症度を判別します。これが、免疫血清検査に用いるラテックス凝集法の検査原理です。
■ラテックス凝集法の技術課題
ラテックス凝集法の最大の技術課題は、免疫血清検査用体外医薬品原料として用いる医用ナノ粒子にあります。一般的なナノ粒子を医用ナノ粒子として用いる場合、血液検体中に含まれる「抗原以外のタンパク質」が「非特異的」に医用ナノ粒子表面に吸着してしまい、この「抗体以外のタンパク質」が糊のように作用し、「血液検体中に抗原が含まれない」においても医用ナノ粒子の凝集トリガーになってしまう場合があります。
ラテックス凝集法では、血液検体に抗原が含まれる場合に凝集、抗原が含まれない場合に分散維持というようにAll or Noneであることが理想で、All or Noneでない挙動は全てがノイズとなり、免疫血清検査の感度低下の原因になってしまいます。
■研究開発の進捗状況
現在、当社のコアコンピタンスの1つであるナノ粒子設計技術を応用し、抗原以外のタンパク質が非特異的に吸着しない医用ナノ粒子の研究開発を進めており、当社製品化プロセスに沿って着実に成果を出しています。当社の医用ナノ粒子が、免疫血清検査に用いるラテックス凝集法の性能を左右するキーマテリアルになることを目指しています。
■マイクロ粘弾性計測用標準粒子開発
マイクロ粘弾性は、「新しい物性値」として学術的にも産業的にも非常に注目されています。バイオ医薬品、特に今後の抗体医薬品開発においてキラーパラメータの1つになると考えられており、現在、多くの計測機器メーカーが競ってマイクロ粘弾性計測機器の製品化を進めています。
事実、本領域における国内大手計測機器メーカーであるO社や海外大手計測機器メーカーであるM社は、既に彼らが製造販売している計測機器のラインナップに、マイクロ粘弾性を計測するためのユニットを搭載しています。
マイクロ粘弾性の計測原理は比較的単純であり、物性既知のナノ粒子と計測対象とを混合し、混合液中における当該ナノ粒子の熱運動を光学的に追尾・解析することによって計測することができます。
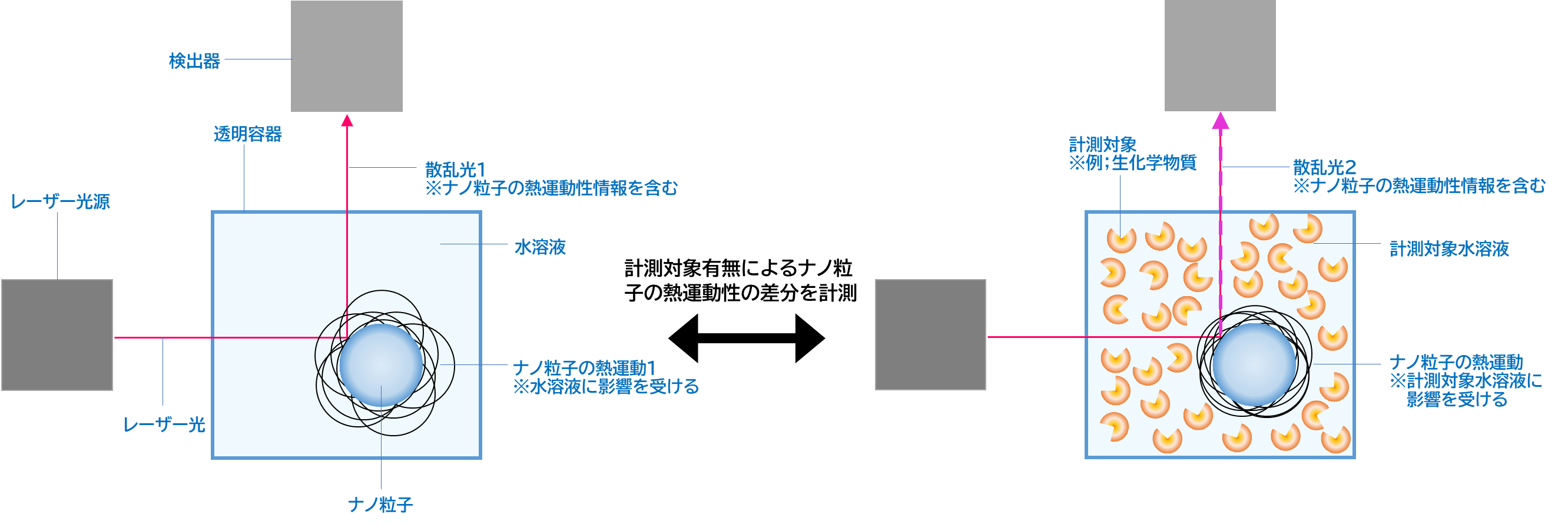
■マイクロ粘弾性計測の技術課題
しかし、現在、マイクロ粘弾性計測に大きな課題が顕在化しています。具体的には、一般的なナノ粒子を用いる場合、このナノ粒子と計測対象との間で相互作用が生じてしまい、マイクロ粘弾性の解析値に無視できないノイズが生じてしまいます。
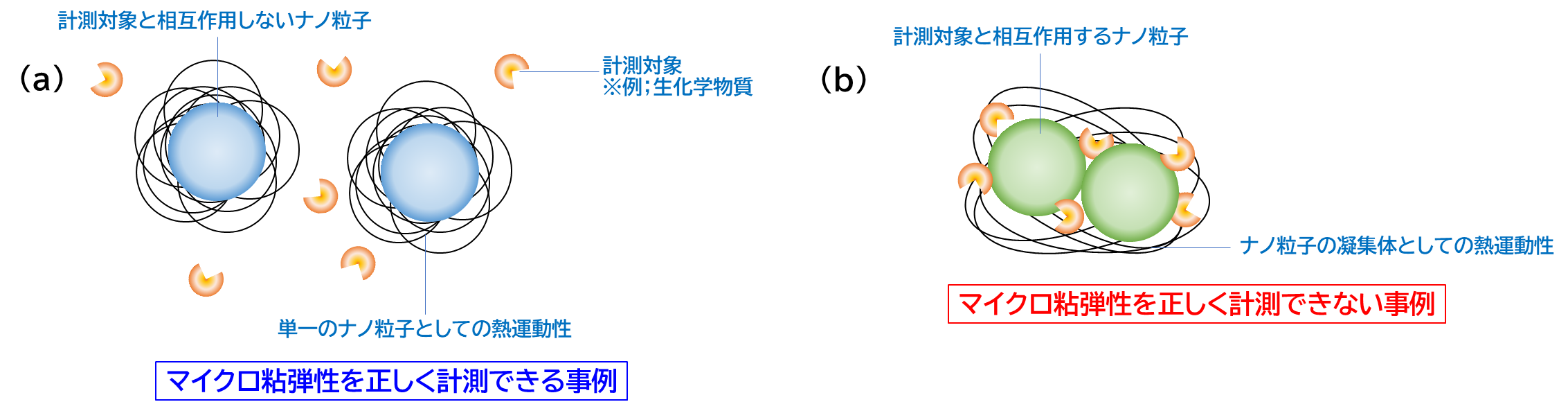
このような理由から、「計測対象と相互作用を生じないナノ粒子」をマイクロ粘弾性計測用標準粒子として具現化することが強く求められています。
■理想的な標準粒子とは
計測対象と標準粒子に作用する主たる相互作用として、疎水性相互作用や静電相互作用、水素結合性相互作用が挙げられ、これらを何れもキャンセルできるナノ粒子がマイクロ粘弾性計測用ナノ粒子として理想的です。
また、標準粒子として必須事項である粒径均一性はもちろんのこと、計測対象の特性に応じて用いる標準粒子の粒径を変更しなければならないケースもあり、相互作用をキャンセルした上で粒径均一性を担保し、且つ、複数の粒径ラインナップを取り揃えておく必要があります。
■研究開発の進捗状況
当社は、マイクロ粘弾性計測においてノイズ原因となる「ナノ粒子と計測対象との相互作用」の中でも、特に「疎水性相互作用」と「静電相互作用」を抑制するため、「ナノ粒子表面を超親水性にすること」と「ナノ粒子のゼータ電位を限りなくゼロに近づけること」の2点を両立する検討を、当社独自の研究開発として製品化プロセスに沿って着実に進捗させており、下記特性を有するナノ粒子の合成と原理検証を完了しています。
- 粒径:100nm~300nmで任意に制御可能
- 粒径均一性:重量平均粒径/個数平均粒径≦1.1
- ゼータ電位:0≦|ゼータ電位(mV)|≦10
- その他特徴:xeno-free
- その他特徴:モデルタンパク質が実質的に吸着しない(超親水性の実現と水素結合性相互作用の抑制)
■用語説明
■マイクロ粘弾性
物体に外力を加えると変形や流動性が生じます。この時の変形し易さを弾性、流れ易さを粘性といい、これらを表現する物性値を粘弾性といいます。立方センチメートル以上の大きさに対して計測する一般的な粘弾性に対し、特に微小空間を計測対象とする物性値をマイクロ粘弾性といいます。
■標準粒子
形状や性質が一定で粒径が揃い、密度や屈折率などの物性値が明確である粒子をいいます。既存産業領域では、電子顕微鏡等の各種計測機器や超高性能エアフィルター等の機能性部材の検定などに用いられています。
■ゼータ電位
粒子を液中に分散した際に粒子表面に発生する電位の大きさを表現する物性値です。
■xeno-free
動物由来の成分を使用していないことを意味します。
■多血小板血漿療法(PRP等)
血液中の血小板を細胞加工して用いる再生医療である多血小板血漿療法は、変形性膝関節症や半月板損傷、テニス肘、五十肩などの治療のための関節内注射、肉離れやアキレス腱など腱の損傷の治療のための関節外注射、難治性潰瘍や褥瘡、重度火傷、薄毛などの治療のための皮膚塗布・皮内注射の他、不妊治療その他幅広い症例に奏功することが知られています。
■PRP等の代表例
- P-PRP(pure-PRP:Platelet-Rich Plasma)
- P-PRP(pure PRP)
- LP-PRP(Leukocyte-Poor PRP)
- LR-PRP(Leukocyte-Pichr PRP)
- APS(Autologous Protein Solution)
- PFC(Platelet-Derived Factor Concentrate)
- PCP(Platelet-Concentrate Plasma)
■PRP等の作用メカニズム
血小板は身体の損傷部位に集まって止血をする働きがあり、その際に多量の成長因子を放出します。この現象を治療に利用する再生医療がPRP等です。血小板に直接的な治療効果があるのではなく、放出される成長因子に治療効果があるため、PRPなどの代表例で挙げた各方法も、投与時に血小板からどれだけ多量の成長因子を抽出できるかという視点で研究開発されており、現在もこの視点で研究開発競争が進められています。
以下には、PRP等に由来する成長因子の種類と治療メカニズムをまとめています。
■血小板由来成長因子:PDGF-aa, ab, bb
- 細胞の複製を刺激し、血管形成を促進
- 上皮形成を促進
- 肉芽組織形成を促進
■形質転換成長因子:TGF-β1, β2
- 細胞外マトリックス形成を促進
- 骨細胞の代謝を調節
■血管内皮成長因子:VEGF
- 血管形成を促進
■繊維芽細胞増殖因子:FGF
- 内皮細胞および繊維芽細胞の増殖を促進
- 血管形成を刺激
■研究開発の進捗状況
当社では、P-PRP、LP-PRP、LR-PRP、APS、PFC、PCPの何れの細胞加工にも対応可能です。中でも、令和5年度沖縄バイオ産業振興補助事業の研究開発成果物では、LR-PRP対して約5倍、約35倍もの成長因子を抽出可能な細胞加工プロトコルを実現しています。5倍細胞加工プロトコルは既に提供できる状態になっています。35倍プロトコルは2025年の実用化を目指しています。
