がクリーンキャップとクリーンスーツとマスクを着衣した状態で細胞培養フラスコ(培地の色:赤)を顕微鏡で観察している写真-67856-1024x796.jpg)
特定細胞加工物受託製造
特定細胞加工物とは、日本の再生医療の分野で使用される、特定の基準と規制を満たす細胞薬のことを指します。特定細胞加工物は、厳格な基準に基づいて製造される必要があり、安全性と効果を保証するために日本の厚生労働省による承認が必要です。
■承認要件
- 細胞培養加工施設(CPC:Cell Processing Center)が、厚生労働省令で定める構造
- 設備の基準に適合していること
- 製造許可を受けるためには、申請者が欠格要件に該当しないこと
- 特定細胞加工物製造届の受理日から1年ごとに各地方厚生局へに定期報告すること
特定細胞加工物は、主に病気の治療や組織の修復、機能の改善を目的とした再生医療に利用されます。安全性の高い医療提供を目指すための厳しい規制と基準が設けられており、医師の指示に基づいて製造され、医療機関に出荷されます。
■特定細胞加工物のラインナップ
当社の細胞培養加工施設(許認可施設番号:FA7230002)では、現在、下記の特定細胞加工物を扱っています。
■αガラクトシルセラミド刺激樹状細胞
- がん免疫療法(NKT細胞標的治療:RIKEN-NKT):第三種再生医療等
■NK細胞
- がん免疫療法(活性化NK細胞療法:ANK療法):第三種再生医療等
■多血小板血漿(PRP・PFC・PCP等)
- 変形性膝関節症や半月板損傷、テニス肘、五十肩などの治療(関節内注射):第二種再生医療
- 腱や筋肉の損傷などの治療(関節外注射):第三種再生医療
- 難治性潰瘍や褥瘡などの皮膚症状の治療:第三種再生医療
- 重度火傷および火傷跡(重度日焼けを含む)の治療:第三種再生医療あるいは院内調剤
- 薄毛治療:第三種再生医療あるいは院内調剤
■脂肪由来間葉系幹細胞
- 変形性膝関節症や半月板損傷、テニス肘、五十肩などの治療(関節内注射):第二種再生医療
- 脳卒中予後:第二種再生医療
- 脊椎損傷予後:第二種再生医療
- 慢性疼痛:第二種再生医療
当社の再生医療事業にご興味を持っていただける医療機関様、医療関係者様、患者様、医療コーディネーター様は、お問い合わせフォームよりご連絡ください。また、ラインナップにない特定細胞加工物の取扱いについてもご相談ください。
当社の細胞培養加工施設は沖縄県うるま市に立地してますが、移輸出体制を整備し、県外の医療機関様にもご案内実績がございます。
■細胞培養加工施設の特徴
施設規模約300平米と九州以南地域では最大級の商用CPCです。薬機法制下で採用される日立グローバルライフソリューションズ株式会社製「次世代モジュール」を国内ではじめて「再生医療製品等に関する安全性の確保等に関する法律(再生医療安全確保法)」制下において採用することで、省エネ(排出CO2量削減)と高度な清浄度管理を実現しています。
安全性と品質の確保、顧客信頼性の向上のため、瞬間停電にも対応可能なCPC専用非常発電システム、24時間365日稼働の環境モニタリングシステム、製造管理システム(MES)を採用している点でもインフラ競争力のある細胞培養加工施設です。
さらに、日立製作所製「再生医療バリューチェーン統合管理プラットフォーム(HVCT_RM)」を利用し、再生医療安全確保法制下では未だ規制しきれていない「検体・特定細胞加工物のトレーサビリティ確保」についてもご案内できます。
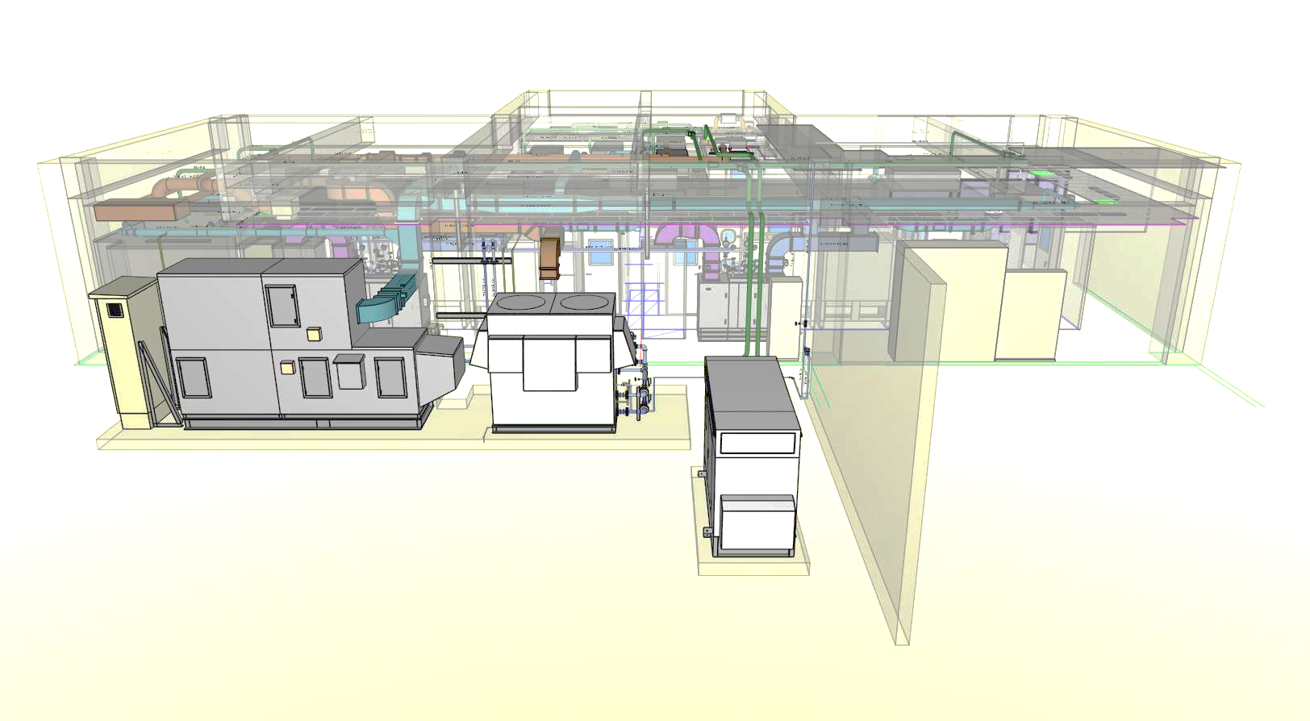
再生医療の透明性と信頼性を確保する目的で、当社細胞培養加工施設の図面を下記通り開示します。
■上面
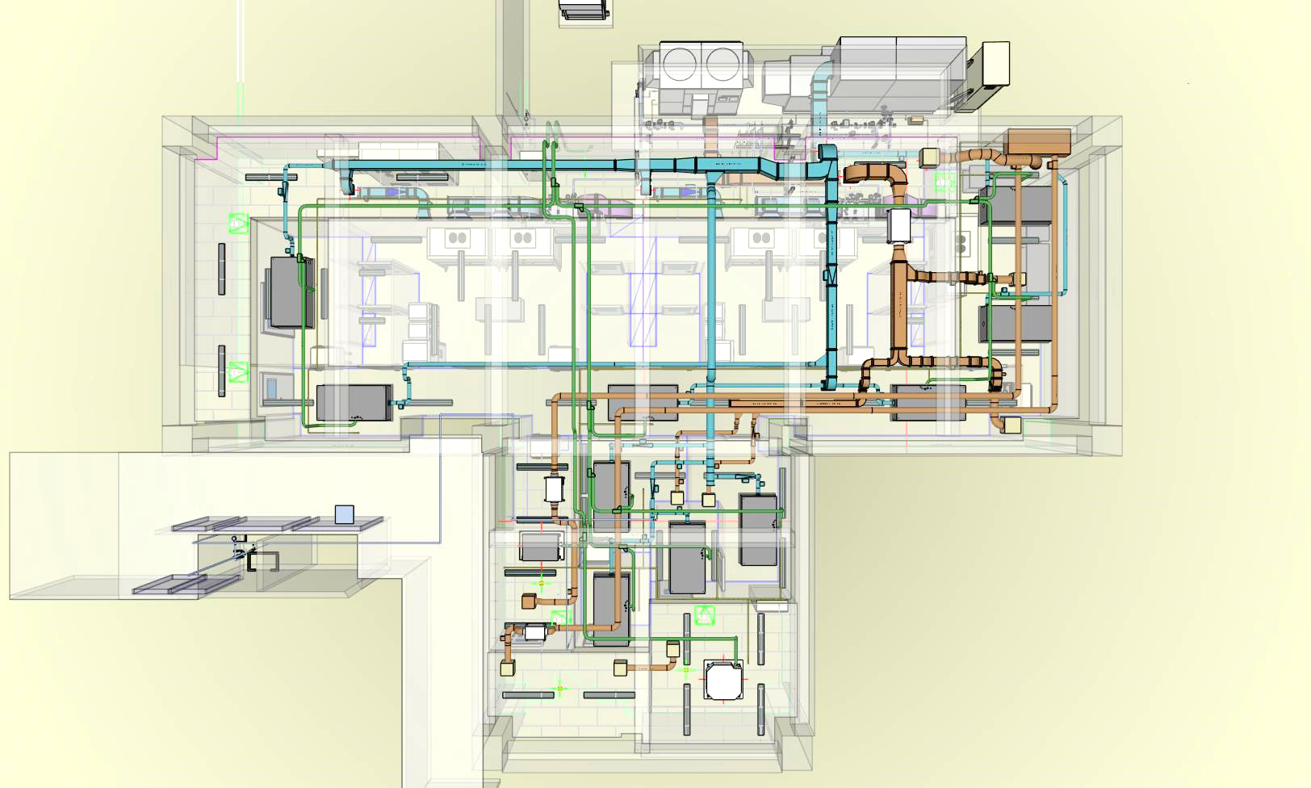
■正面
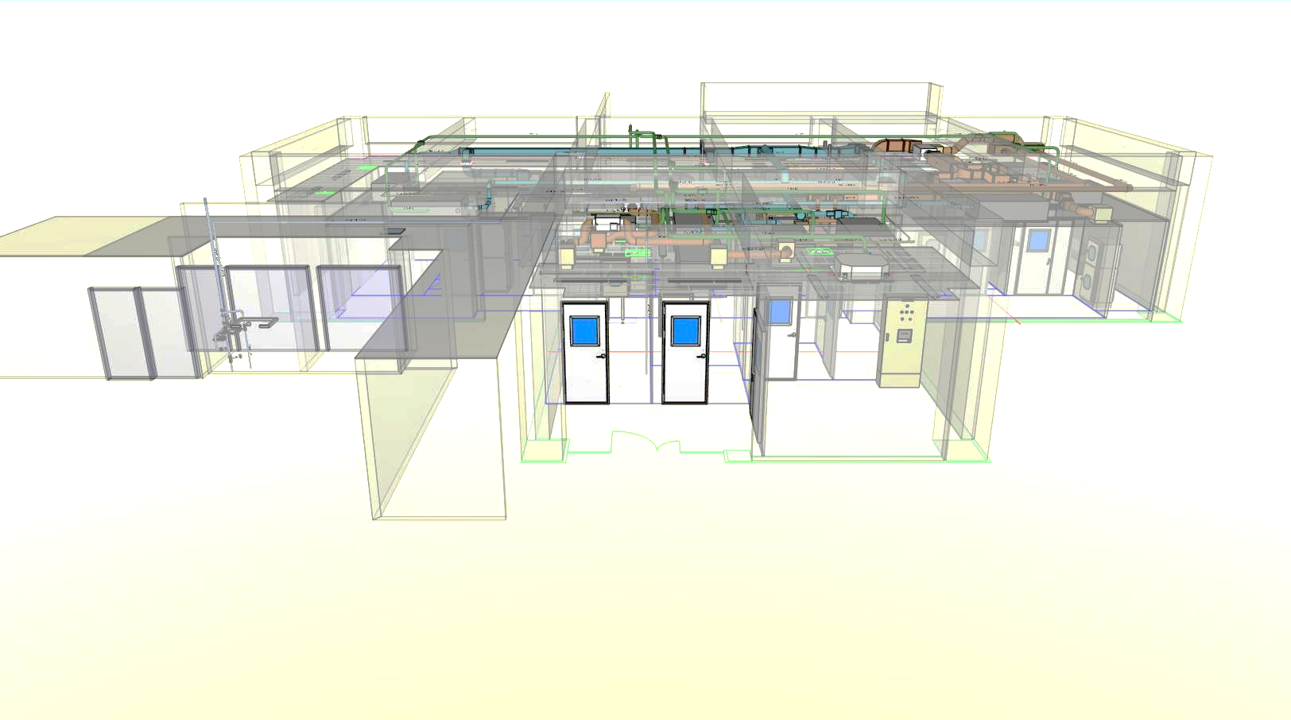
■右側面
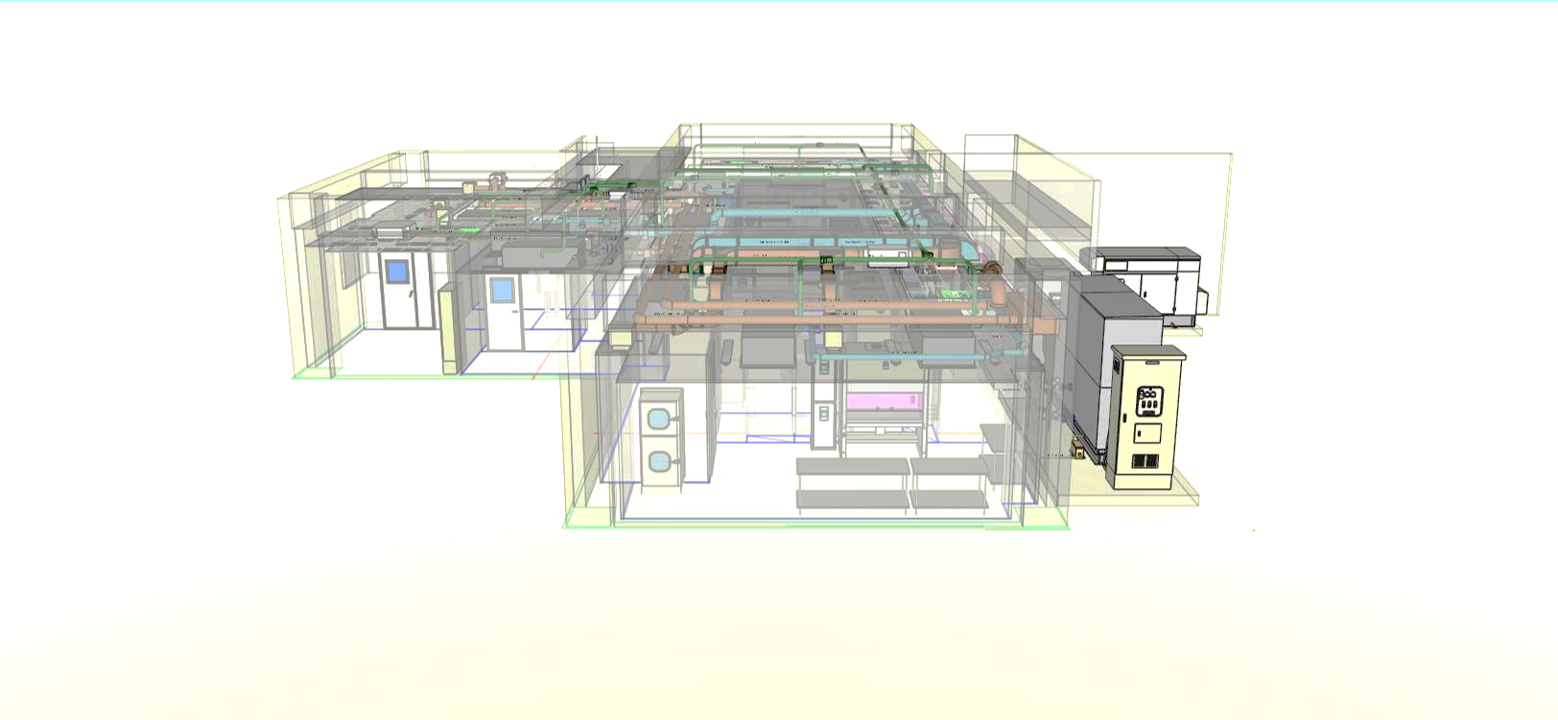
■左側面
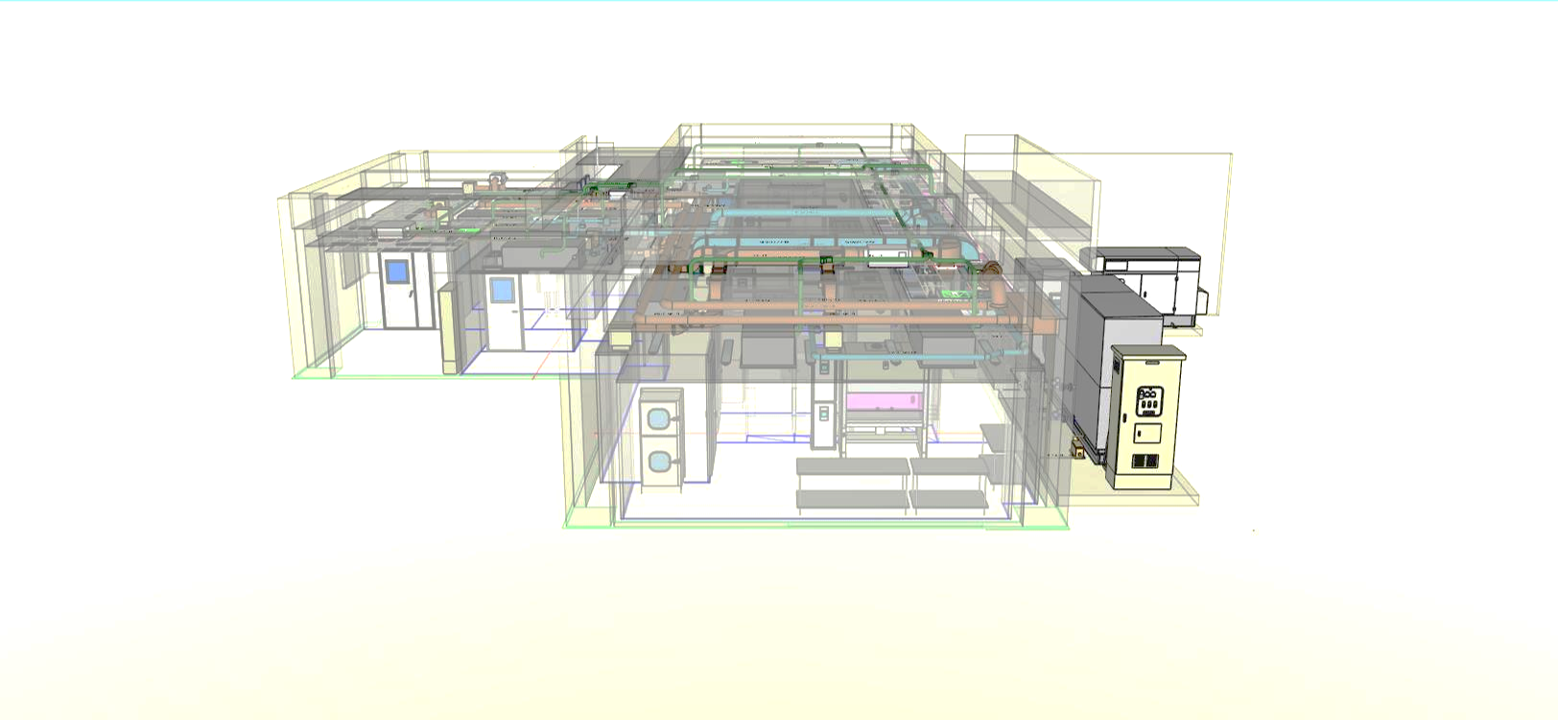
■裏面